مبحث سینتیک شیمی یکی از مباحث مهم و حیاتی در شیمی یازدهم است که در کنکور سراسری نیز به کرات مورد سوال قرار میگیرد. فهم عمیق این مبحث نه تنها به شما کمک میکند تا به سوالات مربوطه پاسخ دهید، بلکه به درک کلیتر از فرایندهای شیمیایی نیز منجر میشود. در این مقاله به بررسی کامل سینتیک شیمی یازدهم، نکات مهم کنکور و سوالات پرتکرار میپردازیم تا آمادگی شما برای امتحانات و آزمون سراسری به حداکثر برسد.
سینتیک شیمی چیست؟
سینتیک شیمی علمی است که به بررسی سرعت واکنشهای شیمیایی و عواملی که بر آن تأثیر میگذارند میپردازد. این موضوع به ما میآموزد که چرا برخی واکنشها سریع و برخی دیگر کند هستند و چگونه میتوان با تغییر شرایط، سرعت واکنش را کنترل کرد. یکی از موضوعات مهم در سینتیک، شناخت دقیق “مسیر واکنش” و “مکانیزم واکنش” است که نقش مهمی در درک کامل رفتار مولکولها در حین واکنش ایفا میکند.
عوامل موثر بر سرعت واکنش
در کنکور، شناخت عوامل موثر بر سرعت واکنش از اهمیت بالایی برخوردار است. این عوامل شامل موارد زیر میباشد:
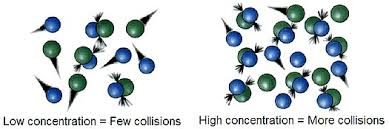
- غلظت واکنشدهندهها: افزایش غلظت باعث افزایش تعداد برخوردها میان مولکولها و در نتیجه افزایش سرعت واکنش میشود.
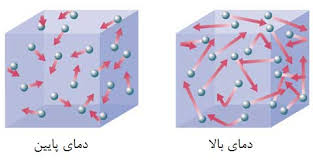
- دمای واکنش: افزایش دما انرژی جنبشی مولکولها را بالا میبرد و احتمال برخوردهای مؤثر را افزایش میدهد.
3. کاتالیزگرها: کاتالیزگرها موادی هستند که بدون مصرف شدن در واکنش، مسیر واکنش را تغییر داده و آن را سریعتر میکنند.
4. سطح تماس: هرچه سطح تماس میان مواد بیشتر باشد، واکنش با سرعت بیشتری انجام میگیرد. این عامل مخصوصاً در واکنشهای جامدات و مایعات اهمیت دارد.
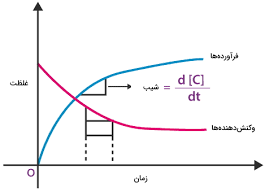
نظریه برخورد و انرژی فعالسازی
نظریه برخورد (Collision Theory) یکی از اصول اساسی در سینتیک شیمی است که بیان میکند واکنشها تنها زمانی رخ میدهند که مولکولها با انرژی کافی و زاویه مناسب با یکدیگر برخورد کنند. این انرژی حداقلی که برای شروع واکنش نیاز است، انرژی فعالسازی نامیده میشود. هرچه انرژی فعالسازی کمتر باشد، سرعت واکنش بیشتر خواهد بود.
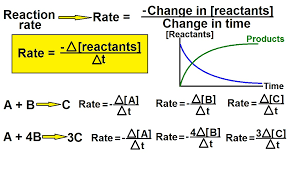
قانون سرعت و مرتبه واکنش
یکی از سوالات پرتکرار کنکور، مرتبط با تعیین قانون سرعت و مرتبه واکنش است. قانون سرعت، رابطهای است که نشان میدهد سرعت واکنش به چه صورت به غلظت واکنشدهندهها بستگی دارد.
برای مثال، واکنشی به صورت زیر را در نظر بگیرید:
[aA + bB —> C]
قانون سرعت میتواند به صورت زیر نوشته شود:
[r = k [A]^m [B]^n]
که در آن (k) ثابت سرعت و (m) و (n) ضرایب تجربی هستند که از آزمایش به دست میآیند و مرتبه واکنش را نسبت به هر ماده مشخص میکنند.
سوالات پرتکرار کنکور درباره سینتیک شیمی
در کنکورهای اخیر، سوالات زیادی از مبحث سینتیک شیمی مطرح شدهاند. در ادامه به چند نمونه از این سوالات اشاره میکنیم:
- اثر تغییر دما بر سرعت واکنش: در این نوع سوالات معمولاً به شما داده میشود که واکنش در دمایی خاص انجام میشود و باید تاثیر افزایش یا کاهش دما بر سرعت را پیشبینی کنید.
- تشخیص کاتالیزگر: این سوالات معمولاً از شما میخواهند که کاتالیزگر موجود در واکنش را شناسایی کنید یا تاثیر حضور آن را بر سرعت واکنش توضیح دهید.
- محاسبه انرژی فعالسازی: گاهی سوالاتی طرح میشود که نیاز به استفاده از نمودار انرژی-پیشرفت واکنش برای محاسبه انرژی فعالسازی دارد.
روشهای افزایش آمادگی برای کنکور در مبحث سینتیک شیمی
برای موفقیت در پاسخ به سوالات سینتیک شیمی، باید تمرکز خود را بر حل سوالات متنوع و تکراری بگذارید. همچنین، توصیه میشود از روشهای زیر استفاده کنید:
- مرور مفاهیم اساسی: مفاهیمی مانند نظریه برخورد و انرژی فعالسازی را به خوبی یاد بگیرید و درک کنید.
- تمرین حل سوالات کنکور سالهای گذشته: سوالات مربوط به سینتیک در کنکورهای گذشته را حل کنید تا با نوع سوالات آشنا شوید.
- استفاده از نمودارها: نمودارهای انرژی-پیشرفت واکنش به شما کمک میکنند تا بهتر متوجه تغییرات انرژی در طول واکنش شوید.
نتیجهگیری
سینتیک شیمی یکی از بخشهای جذاب و چالشبرانگیز شیمی یازدهم است که تسلط بر آن میتواند تاثیر بسزایی در نتیجه نهایی شما در کنکور داشته باشد. با تمرین کافی و درک عمیق مفاهیم، میتوانید به سوالات این مبحث به راحتی پاسخ دهید و درصد بالایی کسب کنید. امیدواریم این مقاله به شما در یادگیری بهتر سینتیک شیمی و موفقیت در کنکور کمک کرده باشد.
سوالات متداول
- چگونه میتوان سرعت واکنش را افزایش داد؟
- با افزایش غلظت واکنشدهندهها، افزایش دما، استفاده از کاتالیزگر و افزایش سطح تماس.
- کاتالیزگر چیست و چه تاثیری بر واکنش دارد؟
- کاتالیزگر مادهای است که سرعت واکنش را بدون تغییر دائمی در خود، افزایش میدهد.
- مرتبه واکنش چیست؟
- مرتبه واکنش مجموع توانهای غلظتها در قانون سرعت است که از دادههای تجربی به دست میآید.