
پرسش پرتکرار: پیوند فلزی چیست و خواص فلزات چگونه به ساختار آنها مرتبط است؟
مقدمه:
فلزات بخشی از زندگی روزمره ما هستند و در هر گوشهای از اطراف ما میتوان آنها را یافت؛ از بدنه خودروها گرفته تا کابلهای برق و جواهرات. درک چگونگی تشکیل پیوندهای فلزی و ویژگیهای فلزات به ما کمک میکند تا بفهمیم چرا فلزات ویژگیهای خاصی مانند رسانایی الکتریکی و حرارتی، انعطافپذیری و جلای فلزی دارند. در این مقاله، به بررسی پیوندهای فلزی، خواص فلزات و نحوه تشکیل آنها میپردازیم و نکات مهمی که در آزمونهای کنکور مورد پرسش قرار میگیرد را بررسی میکنیم.
تعریف پیوند فلزی
پیوند فلزی نوعی پیوند شیمیایی است که بین اتمهای فلزات رخ میدهد. در این نوع پیوند، الکترونهای لایه ظرفیت به صورت آزادانه در بین اتمهای فلزی حرکت میکنند و یک «دریای الکترونی» را تشکیل میدهند. این الکترونهای آزاد باعث میشوند که اتمهای فلزی به هم متصل شده و ساختار بلوری تشکیل دهند. این دریای الکترونی یکی از دلایل اصلی ویژگیهای منحصر به فرد فلزات است.
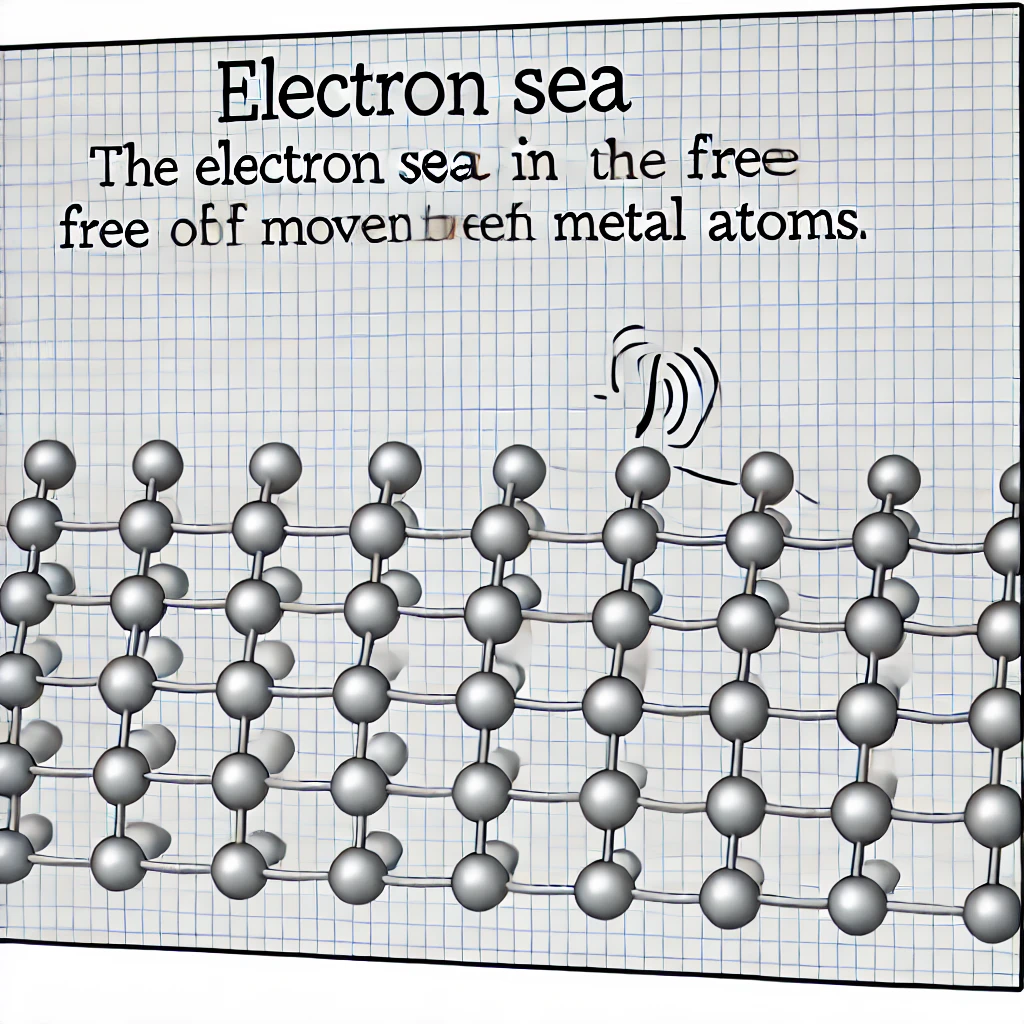
**ویژگیهای فلزات و **پیوندهای فلزی
- رسانایی الکتریکی** و **حرارتی بالا: الکترونهای آزاد در فلزات به راحتی میتوانند در ساختار بلوری حرکت کنند و به همین دلیل فلزات رسانای بسیار خوبی برای الکتریسیته و گرما هستند.
- چکشخواری** و **انعطافپذیری: به دلیل وجود دریای الکترونی، اتمهای فلز میتوانند بدون شکستن ساختار به راحتی روی هم سر بخورند. این خاصیت باعث میشود که فلزات قابل چکشخواری (تبدیل به ورق) و انعطافپذیری (تبدیل به سیم) باشند.
- جلای فلزی: الکترونهای آزاد در سطح فلزات نور را به خوبی بازتاب میدهند و باعث میشوند که فلزات دارای جلا و درخشش خاصی باشند.
- نقطه ذوب و جوش بالا: نیروی جاذبه قوی بین اتمها در ساختار بلوری فلزات باعث میشود که بسیاری از فلزات دارای _نقطه ذوب و جوش بالا_یی باشند.
چگونگی تشکیل پیوند فلزی
پیوندهای فلزی از اشتراک الکترونهای لایه ظرفیت در بین اتمهای فلزی به وجود میآیند. هر اتم فلزی، الکترونهای لایه ظرفیت خود را به دریای الکترونی اضافه میکند و این الکترونها به صورت آزادانه در کل ساختار بلوری حرکت میکنند. این حرکت آزادانه الکترونها باعث میشود که فلزات خواص منحصر به فردی مانند رسانایی و چکشخواری داشته باشند.
**مثالهایی از فلزات و **پیوندهای فلزی
- مس (Cu): مس یکی از بهترین رساناهای الکتریسیته است و در سیمکشیهای الکتریکی بهطور گستردهای استفاده میشود. این ویژگی به دلیل وجود دریای الکترونی و حرکت آزادانه الکترونهاست.
- آلومینیوم (Al): آلومینیوم سبک و چکشخوار است و به همین دلیل در صنایع هوافضا و بستهبندی استفاده میشود. پیوندهای فلزی قوی در آلومینیوم باعث میشوند که این فلز مقاومت بالایی داشته باشد.
تفاوت پیوند فلزی با سایر پیوندهای شیمیایی
- پیوند یونی: در پیوند یونی، الکترونها از یک اتم به اتم دیگر منتقل میشوند و یونهای مثبت و منفی تشکیل میشود. اما در پیوند فلزی، الکترونها به صورت مشترک و آزادانه در بین اتمها حرکت میکنند.
- پیوند کووالانسی: در پیوند کووالانسی، الکترونها بین دو اتم به اشتراک گذاشته میشوند و مولکولهای مشخصی را تشکیل میدهند. اما در پیوند فلزی، الکترونها در کل ساختار فلز به اشتراک گذاشته میشوند و به هیچ مولکول مشخصی تعلق ندارند.
**کاربردهای فلزات و **پیوندهای فلزی
- صنعت ساختمان: فلزاتی مانند آهن و فولاد به دلیل استحکام بالا در ساخت ساختمانها و پلها استفاده میشوند.
- صنعت برق: مس و آلومینیوم به دلیل رسانایی بالای الکتریکی در سیمکشیها و کابلها استفاده میشوند.
- صنایع خودروسازی: فلزاتی مانند فولاد و آلومینیوم در ساخت قطعات خودرو بهکار میروند به دلیل ترکیب استحکام و وزن سبک.
مثالهای پرتکرار امتحانی در شیمی دهم و کنکور
- پرسش: چرا فلزات رسانای خوبی برای جریان الکتریکی هستند؟
- پاسخ: به دلیل وجود الکترونهای آزاد در ساختار فلزی که میتوانند به راحتی حرکت کنند و جریان الکتریکی را هدایت کنند.
- پرسش: چه چیزی باعث چکشخواری فلزات میشود؟
- پاسخ: وجود دریای الکترونی و امکان سر خوردن اتمهای فلزی روی یکدیگر بدون شکستن پیوندها.
- پرسش: تفاوت پیوند فلزی با پیوند یونی چیست؟
- پاسخ: در پیوند فلزی، الکترونها به صورت آزادانه در بین اتمها حرکت میکنند، در حالی که در پیوند یونی، الکترونها از یک اتم به اتم دیگر منتقل میشوند و یونهای مثبت و منفی تشکیل میشود.
جمعبندی
پیوندهای فلزی باعث ایجاد ویژگیهای منحصر به فردی در فلزات میشوند که آنها را از سایر مواد متمایز میکند. خواصی مانند رسانایی الکتریکی و حرارتی، چکشخواری و جلای فلزی همگی به دلیل وجود دریای الکترونی در ساختار فلزات است. درک این پیوندها و خواص فلزات به ما کمک میکند تا از کاربردهای گسترده فلزات در صنایع مختلف آگاه شویم.
پیشنهاد مطالعه بیشتر: برای فهم بهتر پیوندهای فلزی و خواص فلزات، پیشنهاد میشود به مطالعه خواص فیزیکی و کاربردهای مختلف فلزات بپردازید. همچنین، مشاهده ویدیوهای آموزشی که ساختار بلوری فلزات و حرکت الکترونها را نشان میدهد میتواند به درک بهتر این مبحث کمک کند.