مقدمه
ترموشیمی یکی از مباحث اساسی و پرکاربرد در شیمی پایه یازدهم است که درک عمیق آن برای موفقیت در کنکور و امتحانات نهایی ضروری است. این شاخه از شیمی به مطالعه تبادل انرژی، بهویژه گرما، در واکنشهای شیمیایی میپردازد. در این مقاله، به بررسی مفاهیم کلیدی ترموشیمی میپردازیم و سوالات پرتکرار کنکور و امتحانات نهایی را مرور میکنیم.
مفاهیم اصلی ترموشیمی
1. سیستم و محیط
- سیستم: بخشی از جهان که مورد مطالعه قرار میگیرد.
- محیط: همه چیز خارج از سیستم که میتواند با آن تبادل انرژی یا ماده داشته باشد.
2. انواع سیستمها
- سیستم باز: تبادل انرژی و ماده با محیط (مثل کتری جوشان بدون درپوش).
- سیستم بسته: تبادل انرژی با محیط، اما بدون تبادل ماده (مثل بطری آب دربسته).
- سیستم ایزوله: بدون تبادل انرژی و ماده با محیط (مثل فلاسک خلاء ایدهآل).
3. انرژی، کار و گرما
- انرژی درونی (U): مجموع انرژیهای پتانسیل و جنبشی ذرات درون سیستم.
- کار (W): انرژی منتقلشده به دلیل نیرویی که بر سیستم اعمال میشود.
- گرما (Q): انرژی منتقلشده به دلیل اختلاف دما بین سیستم و محیط.
4. قانون اول ترمودینامیک
بیان میکند که انرژی کل یک سیستم ایزوله ثابت است. فرمول:
ΔU=Q−W\Delta U = Q – WΔU=Q−W
- ΔU\Delta UΔU: تغییر انرژی درونی
- Q: گرمای واردشده به سیستم
- W: کاری که سیستم انجام میدهد
5. آنتالپی (H)
خاصیتی ترمودینامیکی که مجموع انرژی درونی و حاصلضرب فشار در حجم است:
H=U+PVH = U + PVH=U+PV
- تغییر آنتالپی (ΔH\Delta HΔH) در فشار ثابت برابر با گرمای مبادلهشده است.
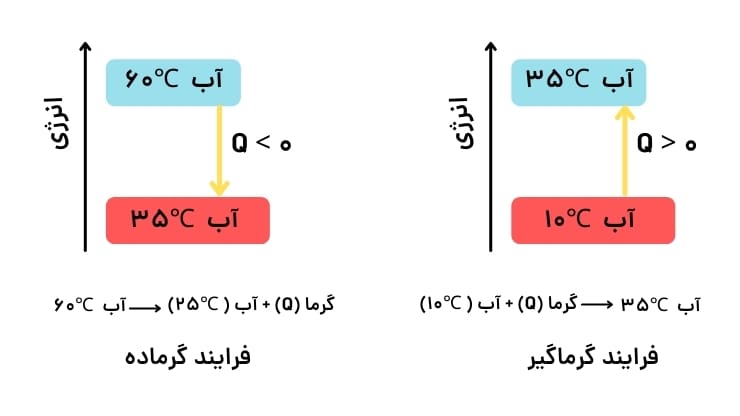
6. واکنشهای گرماده و گرماگیر
- گرماده (Exothermic): واکنشهایی که گرما به محیط آزاد میکنند.
- گرماگیر (Endothermic): واکنشهایی که گرما از محیط جذب میکنند.
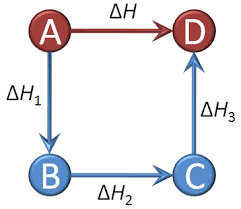
7. قانون هس (Hess’s Law)
تغییر آنتالپی یک واکنش تنها به حالت اولیه و نهایی بستگی دارد، نه به مسیر واکنش. بنابراین، میتوان تغییر آنتالپی واکنشهای پیچیده را با جمع کردن تغییر آنتالپی واکنشهای سادهتر محاسبه کرد.

8. آنتالپی تشکیل و احتراق استاندارد
- آنتالپی تشکیل استاندارد (ΔHf∘\Delta H_f^\circΔHf∘): تغییر آنتالپی تشکیل یک مول از ماده از عناصر سازندهاش در شرایط استاندارد.
- آنتالپی احتراق استاندارد (ΔHc∘\Delta H_c^\circΔHc∘): تغییر آنتالپی سوختن کامل یک مول از ماده در شرایط استاندارد.
سوالات پرتکرار کنکور و امتحانات نهایی
سوال 1:
اگر در یک واکنش شیمیایی ΔH=−200 kJ/mol\Delta H = -200 \, \text{kJ/mol}ΔH=−200kJ/mol باشد، کدام گزینه درست است؟
الف) واکنش گرماگیر است و گرما جذب میکند.
ب) واکنش گرماده است و گرما آزاد میکند.
ج) واکنش در دمای ثابت انجام نمیشود.
د) اطلاعات کافی نیست.
پاسخ: گزینه ب صحیح است. چون ΔH\Delta HΔH منفی است، واکنش گرماده بوده و گرما آزاد میکند.
سوال 2:
کدام یک از موارد زیر نمونهای از سیستم ایزوله است؟
الف) فلاسک خلاء ایدهآل
ب) کتری آب جوشان
ج) بطری نوشابه دربسته
د) سلول الکترولیتی باز
پاسخ: گزینه الف صحیح است. فلاسک خلاء ایدهآل تبادل انرژی و ماده با محیط ندارد و سیستم ایزوله است.
سوال 3:
طبق قانون هس، تغییر آنتالپی کل واکنش:
الف) به مسیر واکنش بستگی دارد.
ب) به تعداد مراحل واکنش بستگی دارد.
ج) فقط به حالت اولیه و نهایی بستگی دارد.
د) به دما و فشار بستگی ندارد.
پاسخ: گزینه ج صحیح است. قانون هس بیان میکند که تغییر آنتالپی فقط به حالت اولیه و نهایی بستگی دارد.
سوال 4:
در یک فرآیند، 50 کیلوژول گرما به سیستم داده میشود و سیستم 20 کیلوژول کار روی محیط انجام میدهد. تغییر انرژی درونی سیستم چقدر است؟
الف) ΔU=+70 kJ\Delta U = +70 \, \text{kJ}ΔU=+70kJ
ب) ΔU=+30 kJ\Delta U = +30 \, \text{kJ}ΔU=+30kJ
ج) ΔU=−30 kJ\Delta U = -30 \, \text{kJ}ΔU=−30kJ
د) ΔU=−70 kJ\Delta U = -70 \, \text{kJ}ΔU=−70kJ
پاسخ:
ΔU=Q−W\Delta U = Q – WΔU=Q−W
ΔU=50 kJ−20 kJ=+30 kJ\Delta U = 50\, \text{kJ} – 20\, \text{kJ} = +30\, \text{kJ}ΔU=50kJ−20kJ=+30kJ
بنابراین، گزینه ب صحیح است.
سوال 5:
اگر آنتالپی تشکیل استاندارد آب مایع −285.8 kJ/mol-285.8 \, \text{kJ/mol}−285.8kJ/mol باشد، آنتالپی احتراق استاندارد هیدروژن گازی چقدر است؟
الف) −285.8 kJ/mol-285.8 \, \text{kJ/mol}−285.8kJ/mol
ب) +285.8 kJ/mol+285.8 \, \text{kJ/mol}+285.8kJ/mol
ج) −571.6 kJ/mol-571.6 \, \text{kJ/mol}−571.6kJ/mol
د) +571.6 kJ/mol+571.6 \, \text{kJ/mol}+571.6kJ/mol
پاسخ:
معادله احتراق هیدروژن:
2H2(g)+O2(g)→2H2O(l)2H_2 (g) + O_2 (g) \rightarrow 2H_2O (l)2H2(g)+O2(g)→2H2O(l)
تغییر آنتالپی برای 2 مول آب:
ΔH=2×(−285.8 kJ/mol)=−571.6 kJ\Delta H = 2 \times (-285.8\, \text{kJ/mol}) = -571.6\, \text{kJ}ΔH=2×(−285.8kJ/mol)=−571.6kJ
بنابراین، گزینه ج صحیح است.
نتیجهگیری
ترموشیمی با مفاهیم اساسی خود نقش مهمی در درک واکنشهای شیمیایی و تبادل انرژی دارد. با تسلط بر این مفاهیم و تمرین سوالات پرتکرار، میتوانید عملکرد بهتری در کنکور و امتحانات نهایی داشته باشید. به یاد داشته باشید که درک عمیق مفاهیم و حل مسائل متعدد کلید موفقیت در این زمینه است.
o1
